作者:覃小洁 李海超 来源:广西药物精准检测与筛选重点实验室 发布时间:2024-05-30
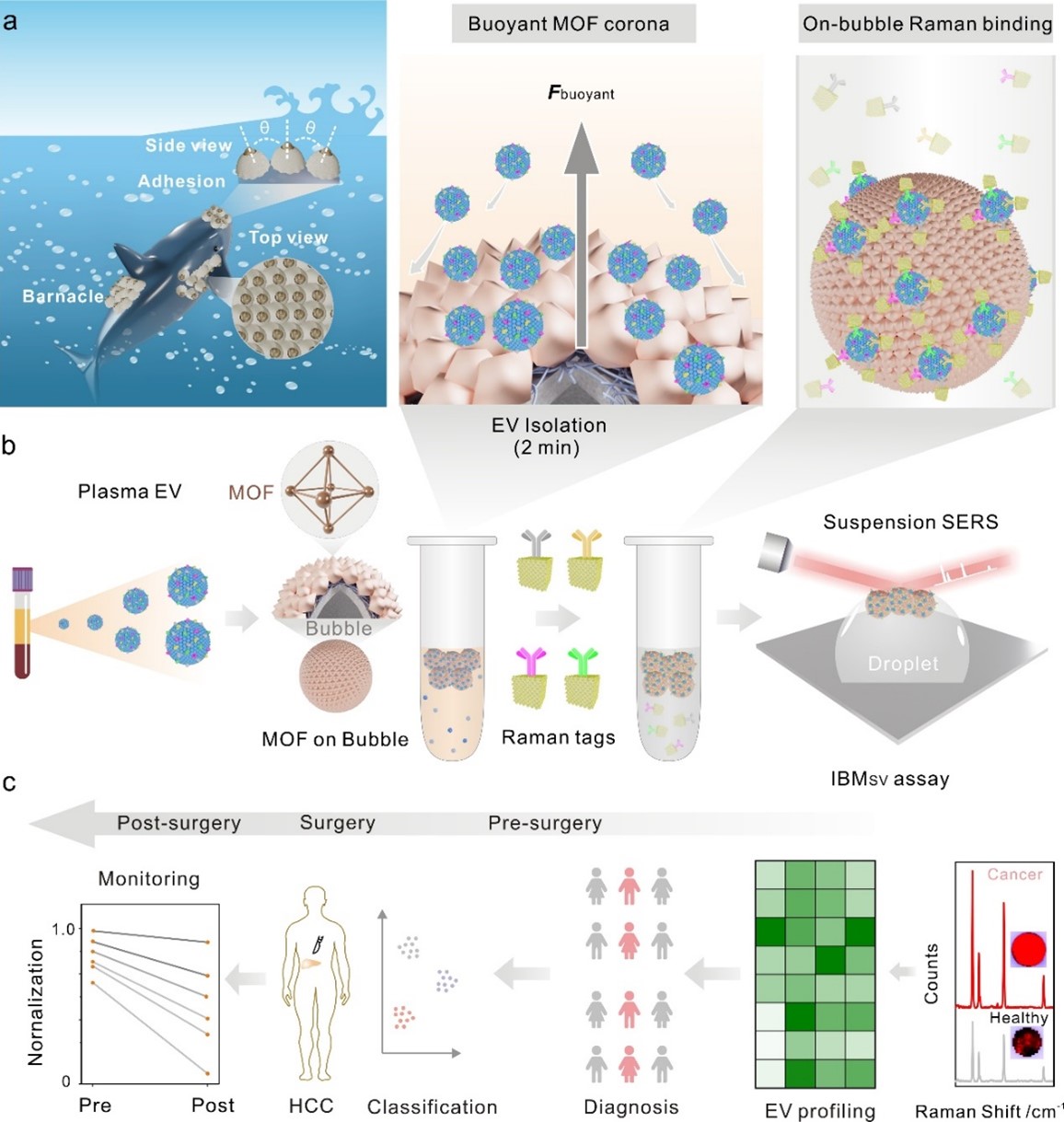
近日,广西药物精准检测与筛选重点实验室在循环细胞外囊泡(EVs)分离检测研究领域取得新进展,实验室主任杨帆教授联合中山大学药学院张元庆团队设计了一种浮力驱动、EV配位靶向、金属有机框架(MOF)高密度组装的MOF纳米冠,可显著提升循环EVs的分离检测能力。研究成果以“Buoyant Metal-Organic Framework Corona-Driven Fast Isolation and Ultrasensitive Profiling of Circulating Extracellular Vesicles”为题,发表在美国化学学会权威期刊《ACS Nano》(IF: 17.1,中科院一区TOP)上。覃小洁博士为论文第一作者,杨帆教授为论文通讯作者,张元庆教授为共同通讯作者。

由肿瘤细胞或组织分泌的细胞外囊泡(extracellular vesicles, EVs)会进入人体循环系统,参与细胞间通讯和信号分子转移,远程调控恶性肿瘤等重大疾病的发生发展。精准检测肿瘤来源的循环EVs分子信息对实现非侵入性癌症早诊早治及其治疗监测至关重要,但如何高效分离并精准检测高度分散的“生物胶体”—EVs依然面临大的挑战。
本文中,研究人员受海洋生物表面藤壶粘附和微观纳米蛋白冠现象启发,以自驱动固态微气泡为模板,以聚电解质PEI纳米层为“藤壶胶”,发展了一种浮力驱动、EV配位靶向、金属有机框架(MOF)高密度组装的MOF纳米冠。利用气泡表面高曲率MOF的金属离子(Zr4+)与EV磷脂膜之间的配位识别,耦合双编码多色拉曼纳米标签,实现了血浆中EVs的快速分离和超灵敏表型多元SERS分析。这种集气泡驱动-MOF纳米冠识别-悬浮SERS多色检测于一体的EVs分离分析方法(即IBMsv),不仅可以诱导MOF在自漂浮的气泡表面像藤壶粘附般高密度组装,增强EVs与MOF之间的结合,实现EVs的快速高效分离(2 min内分离效率近90%);还可耦合四重双编码SERS纳米标签,在单颗粒水平实现EVs表面蛋白标志物的多元超灵敏检测。
其优势包括:(1)相比传统固态传感界面上的被动扩散分子识别,仿生粘附设计原理指导MOF配位识别层在气泡表面高密度组装,形成自驱动高曲率的EV靶向纳米冠,通过主动碰撞,增强MOF-EV磷脂膜之间的配位识别来提高EV的分离效能;(2)多重拉曼-免疫双编码SERS纳米标签能够同时高灵敏、高特异性的分析循环EVs表面4种不同蛋白标志物的表达谱,并结合机器学习,提高肿瘤诊断和治疗监测的准确性;(3)浮力驱动自分离模式诱导拉曼气泡复合物在液滴顶端自聚集,形成悬浮SERS界面,从而有利于EVs分离并进行原位、便携SERS检测,避免了咖啡环效应引起的拉曼信号不均一性问题。
此外,IBMsv方法实现了五种不同癌症细胞来源EVs的表型分析,揭示了不同EVs表面蛋白表达的异质性,并准确监测了药物诱导EV表型的动态变化。该方法还对临床样本(n = 55)中多种肿瘤EVs表面的4种蛋白标志物(CD63、EpCAM、EGFR、HER2)进行SERS检测,实现了肿瘤疾病的精准诊断(准确率>95%),通过机器学习进一步提高了非癌症和癌症患者的区分能力,并监测了肝细胞癌患者手术治疗的响应情况。总体上,该方法为癌症诊断和临床治疗监测提供了一种快速、灵敏、多元和便携式的液体活检工具。
原文链接: https://pubs.acs.org/doi/10.1021/acsnano.4c02339
同时,文章被“Interdisciplinary MEDICINE”,“BioMed科技”等著名公众号推送。

公众号文章链接:https://mp.weixin.qq.com/s/da6v_T4FXKmZIACo3AmMXg

公众号文章链接:https://mp.weixin.qq.com/s/25oKl50j_fXlMtLNERQ5sw
版权所有:广西药物精准检测与筛选重点实验室